摘 要:目的 观察糖基化终产物( AGE)与金属蛋白酶诱导物( EMMPRIN)及基质金属蛋白酶( MMP)的关系,研究 AGE是否通过 EMMPRIN/ MMP途径影响Ⅰ型胶原的代谢。方法 用 AGE-牛血清蛋白( BSA)、 EMMPRIN抗体、 AGE-BSA + EMMPRIN抗体分别干预小鼠成骨样细胞和巨噬细胞构建的共培养体系 24 h,采用酶联免疫吸附分析法( ELISA)检测Ⅰ型胶原含量。将不同浓度的 AGE-BSA( 0、 50、 100、 200、 400 mg/L)干预共培养的细胞 24 h,用半定量逆转录聚合酶链反应( RT-PCR)检测成骨细胞Ⅰ型胶原 mRNA表达,明胶酶谱法测定 MMP-2和 MMP-9的分泌量。结果 AGE-BSA干预后上清液中Ⅰ型胶原含量显著降低, EMMPRIN抗体组Ⅰ型胶原含量增加, EMMPRIN抗体 + AGE-BSA组Ⅰ型胶原水平显著增加。不同浓度 AGE-BSA干预共培养体系后,Ⅰ型胶原 mRNA表达与对照组相比显著增加,且随 AGE-BSA干预浓度增加而增加; MMP-2、 MMP-9分泌水平较对照组均显著增加,并随 AGE-BSA干预浓度增加而增加。结论 在体外随着 AGE浓度的增加刺激 EMMPRIN/MMP分泌,促进Ⅰ型胶原降解,进而影响骨质的代谢。
关键词:AGE;Ⅰ型胶原;MMP;EMMPRIN
中图分类号:R446.1 文献标志码:A 文献编号:1009-7090(2017)
Ⅰ型胶原是骨基质的重要组成成分,主要用来吸收和传递骨基质内部应力,用于各种牵
拉引起的变形和维持必要的张力。MMP是细胞外基质的主要酶降解系统,能降解除多糖外的所有细胞外基质成分,其合成及表达受细胞外基质金属蛋白酶诱导物EMMPRIN的调控。研究证实糖基化终产物AGE大量积聚于疏松的骨质组织中,AGE积聚可引起皮质骨和小梁骨机械特性降低,使骨质脆性增加,极易造成骨折[1]。笔者通过体外制备AGE-牛血清蛋白,干预成骨细胞与破骨前体细胞组成的共培养体系,检测EMMPRIN/MMP系统变化时Ⅰ型胶原的含量,探讨AGE通过EMMPRIN/MMP方式对Ⅰ型胶原代谢产生的影响。
1 材料与方法
1.1 实验材料与试剂
1.1.1 实验细胞
由中国科学院上海生命科学研究院提供的小鼠成骨样细胞株及巨噬细胞株。
1.1.2 仪器
9700型聚合酶链反应仪(ABI,美国);荧光光谱扫描仪(UVP,美国)。
1.1.3 主要试剂
牛血清蛋白(Amresco,美国);含L-谷氨酰胺、RNA及DNA的α-最小必需培养液(Gibco,美国);胎牛血清(杭州四季青公司);小鼠Ⅰ型胶原酶联免疫吸附分析试剂盒(R&D,美国);Ⅰ型胶原mRNA、MMP-2、MMP-9试剂及EMMPRIN抗体。
1.2 方法
1.2.1 AGE-BSA的制备
取浓度为5 g/L BSA、浓度为50 mmol/L葡萄糖,充分溶解于pH 7.4的磷酸盐缓冲液后,惊醒过滤与除菌,然后置于37 ℃条件下避光90 d。将未结合的葡萄糖用PBS进行透析除去后,收集AGE。用荧光光谱扫描仪对AGE水平进行分析鉴定,不含葡萄糖的BSA作为阴性对照。
1.2.2 细胞培养及干预
用含10 %胎牛血清的α-MEM,于37 ℃、体积分数5 % CO2培养箱培养MC3T3E1和 RAW264.7。取对数生长期的MC3T3E1和RAW264.7细胞,放入已准备好的Transwell小室6孔板中,设3个复孔,于7 ~ 10 d后,再移RAW264.7细胞至相应孔内,等融合至75 % ~ 95 %时,将Transwell小室移到MC3T3E16孔板中,接着用无血清α-MEM饥饿24 h。
取AGE-BSA(50 mg/L)、EMMPRIN抗体(5 mg/L)、AGE-BSA(50 mg/L) + EMMPRIN抗体(5 mg/L)分别干预共培养体系24 h,将α-MEM干预24 h,然后收集上清液。严格按说明书检测Ⅰ型胶原水平。
分别加入不同浓度的AGE-BSA细胞,将不含葡萄糖的BSA作为阴性对照组,每组3个复孔,一天后进行收集,用于测定上清液中Ⅰ型胶原mRNA、MMP-2及MMP-9水平。
1.2.3 成骨细胞Ⅰ型胶原mRNA的表达
A260 nm与 A280 nm比值在160 ~ 180。取2 μL总RNA为模板逆转录。扩增条件:94 ℃预变性3 min,然后94 ℃ 1 min、56 ℃ 1 min、72 ℃ 1 min进行30个循环扩增,再以72 ℃延伸10 min。反应完成后,取5 μL PCR产物于20 g/L琼脂糖凝胶在100 V电泳40 min,用Sensicapture扫描凝胶图谱,用 Labimag完成RNA条带进行扫描,得出目的条带与内参条带的光密度(OD)比值,比较各组Ⅰ型胶原mRNA表达情况。
1.2.4 细胞培养上清液中MMP-2、MMP-9的活性
取培养细胞上清液与4 × 上样缓冲液[10 %十二烷基硫酸钠1 g,4 %蔗糖0.4 g,0.1﹪溴酚蓝0.01 g,0.25 mol Tris-HCl]按1∶3混匀,上样后冰上冷却100 V电泳约2.5 h。将胶浸于2.5 % Triton X-100中振荡洗涤1.5 h,再浸泡于孵育缓冲液中(50 mmol Tris-HCl,5 mmol/L CaCl2,0.2 mol NaCl,0.02 % Briji-35,pH 7.6)在37 ℃环境孵育18 h,用考马斯亮蓝染色,然后进行脱色处理。通过BandScan图像分析软件,查看条带面积和灰度,酶含量 = 条带面积 × (条带灰度 - 背景灰度)。
1.3 统计学方法
用SPAS 16.0软件进行。数据以均数 ± 标准差表示,3组间用方差进行对比分析,2组间用LSD-t进行检验分析。P < 0.05为差异有统计学意义。
2 结果
2.1 不同抗体对共培养体系Ⅰ型胶原水平的影响
α-MEM基础培养中Ⅰ型胶原含量为51.3 μg/L,AGE-BSA(50 mg/L)、EMMPRIN抗体(5 mg/L)、AGE-BSA(50 mg/L) + EMMPRIN抗体(5 mg/L)共培养体系上清中Ⅰ型胶原含量分别为47.1、56.7、49.1 μg/L。
2.2 Ⅰ型胶原mRNA表达
BSA干预共培养细胞,Ⅰ型胶原mRNA与β-actin OD比值为0.732;α-MEM干预共培养细胞,Ⅰ型胶原mRNA与β-actin OD比值为0.713;用SPAS 16.0软件进行两组比较,差异无统计学意义(P > 0.05)。AGE-BSA 50、100、200、400 mg/L干预共培养细胞,Ⅰ型胶原mRNA与β-actin OD比值分别为0.787、0.826、0.889、1.430;与BSA组、α-MEM组比较,用SPAS 16.0软件进行分析,差异均有统计学意义(P > 0.05)。见图1。

1 ~ 4:AGE-BSA(50、100、200、400 mg/L)干预共培养体系;5:AGE-BSA(400 mg/L)干预MC3T3E1。
图1 不同浓度AGE-BSA对共培养体系中Ⅰ型胶原mRNA表达的影响
2.3 上清液MMP-2、MMP-9测定
BSA干预共培养细胞,上清液中MMP-2、MMP-9水平分别为40.865、144.700;而α-MEM干预共培养细胞,细胞培养上清液中MMP-2、MMP-9水平分别为41.467、211.26;用SPAS 16.0软件进行分析,两组差异无统计学意义(P > 0.05)。AGE-BSA 50、100、200、400 mg/L干预共培养细胞,细胞培养上清液中MMP-2、MMP-9水平逐渐升高,与BSA组、α-MEM组比较,用SPAS 16.0软件进行分析,差异有显著统计学意义(P < 0.05)。见表1、图2和图3。
表1 不同浓度AGE-BSA干预共培养体系对MMP-2、MMP-9表达的影响
| 项目 | α-MEM | BSA | AGE-BSA | |||
| 50 / mg/L | 100 / mg/L | 200 / mg/L | 400 / mg/L | |||
| MMP-2 / INT·mm2 | 41.467 | 40.865 | 75.338 | 117.58 | 138.71 | 158.32 |
| MMP-9 / INT·mm2 | 211.260 | 144.700 | 451.25 | 578.86 | 667.01 | 751.13 |

1 ~ 4:AGE-BSA(50、100、200、400 mg/L)干预共培养体系;5:AGE-BSA(400 mg/L)干预单独培养MC3T3E1;6:AGE-BSA(400 mg/L)干预单独培养RAW264.7。
图2 不同浓度AGE-BSA干预共培养体系对MMP-2分泌的影响
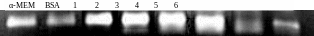
1 ~ 4:AGE-BSA(50、100、200、400 mg/L)干预共培养体系;5:AGE-BSA(400 mg/L)干预单独培养MC3T3E1;6:AGE-BSA(400 mg/L)干预单独培养RAW264.7。
图3 不同浓度AGEs-BSA干预共培养体系对MMP-9分泌的影响
3 讨论
AGE由I型胶原在体外经过非酶化产生,与骨质疏松的关系十分密切,患者体内AGE的聚集可引起老年性痴呆、肾病、神经性疾病等病变,学者刘阳等人研究表明AGE通过作用RNA对MMP-1和TIMP-1表达的影响[2],AGE对纤维细胞组织蛋白酶表达及其活性也产生一定的影响;同时围绕AGE对各种糖尿病慢性并发症如糖尿病肾病、骨质疏松、神经性疾病等也进行了大量的临床实验与研究,因此目前AGE是临床实验研究的热点之一[3]。
国内外学者就AGE、MMP 和EMMPRIN进行了大量的研究[4],但它们三者具体是什么样的关系等还缺少一定的实验数据。笔者研究结果显示AGE-BSA干预后上清液中Ⅰ型胶原含量显著降低,EMMPRIN抗体组Ⅰ型胶原含量增加,EMMPRIN抗体 + AGE-BSA组Ⅰ型胶原水平显著增加;不同浓度 AGE-BSA干预共培养体系后,Ⅰ型胶原 mRNA表达与对照组相比显著增加,且随AGE-BSA干预浓度增加而增加,MMP-2、MMP-9分泌水平较对照组均显著增加,并随AGE-BSA干预浓度增加而增加。
综上所述,AGE可通过在体外促进MMP-2和MMP-9的分泌,增加Ⅰ型胶原的降解速率。固然Ⅰ型胶原的基因表达显示合成增加,但其降解速率可能远远多于合成速率,进而打破Ⅰ型胶原合成与降解之间的平衡,影响骨基质代谢、降低骨强度进而产生骨质疏松的发病。
参考文献:
[ 1 ] Jackuliak P, Payer J. Osteoporosis, fractures, and diabetes[J]. Int J Endocrinol, 2014, 2014:820615-820615.
[ 2] Liu Y, Xia JR. Effect of siRNA-mediated down regulation of receptor for advanced glycation end products on expression of matrix metalloproteinase-1 and tissue inhibitor of metalloproteinase-1 in rat hepatic stellate cells and hepatic fibrosis[J]. Shijie Huaren Xiaohua Zazhi, 2015, 23(19): 3012-3021.[刘阳,夏金荣. 晚期糖基化终产物受体特异性小干扰RNA对MMP-1和TIMP-1表达的影响[J]. 世界华人消化杂志, 2015, 23(19): 3012-3021.]
[ 3] Li Ziqing. Advanced glycation end products influence osteoclast-induced bone resorption[J]. Chinese Journal of Tissue Engineering Reaserch, 2016, 20(20): 2907-2914.[李子卿. 晚期糖基化终末产物可影响破骨细胞的骨吸收功能[J].中国组织工程研究,2016,20(20):2907-2914.]
[ 4 ] LIU Li-li. Study on the relativity between serum advanced glycosylation end product and polycystic ovary syndrome[J/CD]. Chinese Journal of Clinicians(Electronic Edition), 2016, 10(20 ): 2989-2992.[刘丽丽. 血清晚期糖基化终产物表达水平与多囊卵巢综合征的相关性[J]. 中华临床医师杂志,2016,10(20):2989-2992.]
作 者单位:1.徐州市第一人民医院检验科,江苏 徐州 221002,2. 徐州医学院生化教研室,江苏 徐州 221004
者单位:1.徐州市第一人民医院检验科,江苏 徐州 221002,2. 徐州医学院生化教研室,江苏 徐州 221004
作者简介:牛璐璐(1975-),女,江苏省人(回族),本科,副主任技师,主要从事临床生物化学及分子生物学研究。
基金项目:徐州市科技局社会发展项目(KC15SH040)
通讯作者:王丽(19700),女,江苏省人,硕士研究生,主任技师,主要从事临床生物化学及分子生物学研究。
版权©保护,不得翻录。
4